Aspetti clinici della cheratite da Acanthamoeba
Non è possibile stabilire con sicurezza l’intervallo temporale tra l’acquisizione dell’infezione ed il momento in cui si manifestano i primi segni e sintomi. Comunque la fase di esordio può durare diverse settimane, con sintomatologia lieve e sfumata. I sintomi sono aspecifici e possono andare da una semplice sensazione di corpo estraneo a lievi disturbi (modesta irritazione oculare). Può essere presente iperemia congiuntivale, ma il paziente non avverte ancora dolore. Al contrario, in questa fase è stata descritta una riduzione della sensibilità corneale (Moore et al., 1986; Auran et al., 1987) che può erroneamente indirizzare verso la diagnosi di cheratite erpetica.
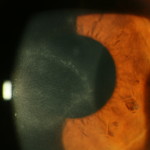
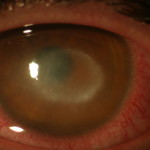
La cornea può presentare microcisti subepiteliali che, rompendosi, daranno origine a lesioni epiteliali molto simili a quelle erpetiche (pseudodendrite) (Fig. 1). In seguito compare la limbite, iperemia congiuntivale pericheratica, cosiddetta perché caratteristicamente localizzata in prossimità del “limbus” (Fig.2). La diagnosi differenzialein questa fase deve comprendere le cheratiti sterili e quelle infettive. Le cheratiti non infettive possono essere secondarie ad un abuso della LAC o a reazioni tossiche o allergiche al liquido di conservazione delle LAC o a medicamenti. Le cheratiti infettive invece devono comprendere le forme erpetiche, quelle batteriche (in particolare da batteri atipici come i micobatteri o Nocardia spp.) e le micotiche.
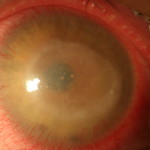
Lo stadio intermedio è caratterizzato dalla comparsa della sintomatologia: intensa fotofobia, lacrimazione e dolore, solitamente sproporzionato all’entità del quadro clinico. A livello corneale si evidenziano segni di coinvolgimento dello stroma, inizialmente caratterizzato da un infiltrato con epitelio integro, seguito poi da ulcerazione (Fig.3). Spesso è presente un infiltrato “ad anello” attorno al focolaio infettivo, segno della risposta immunitaria dell’ospite e in questa fase compaiono gli infiltrati perineurali con distribuzione radiale.
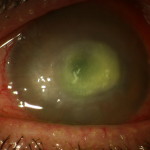
Nello stadio più avanzato si osserva un ulteriore peggioramento della sintomatologia, che a volte è accompagnata da un dolore così intenso da richiedere l’uso di antidolorifici maggiori (morfina). Anche il quadro clinico si aggrava ulteriormente e compare una necrosi colliquativa, che può portare alla perforazione (Fig. 4). In questa fase possono comparire anche segni di compromissione del segmento anteriore con midriasi areagente ed atrofia iridea, cataratta, ipertono e/o coinvolgimento sclerale.
Una volta risolta l’infezione, a seconda della gravità del quadro clinico e soprattutto del tempo intercorso dalla diagnosi all’inizio del trattamento, la riparazione può avvenire con ripristino di tessuto corneale trasparente oppure con la formazione di un leucoma. Solitamente la cornea si vascolarizza nella prima fase della guarigione e una volta terminato il processo riparativo i vasi spontaneamente si schiudono lasciando, il più delle volte, un leucoma non vascolarizzato.
A distanza di settimane dalla risoluzione del processo infettivo può verificarsi una recrudescenza della sintomatologia causata dalla comparsa di infiltrati subepiteliali e stromali, da depositi endoteliali e da uveite anteriore, che non rappresentano una riacutizzazione dell’infezione, ma una risposta immunitaria ad antigeni parassitari sequestrati.
La diagnosi di cheratite da Acanthamoeba si basa sulla identificazione microscopica diretta e/o colturale delle cisti e dei trofozoiti previo prelievo di epitelio o di tessuto in disfacimento sui bordi dell’ulcera mediante spatola. In alcuni casi il focolaio infettivo può essere così profondo da richiedere un prelievo di stroma mediante biopsia. Quando possibile è sempre indicato eseguire la ricerca del parassita anche nel liquido di conservazione delle LAC e sulle LAC stesse opportunamente frammentate ed entrambi posti in coltura. Gli esami microbiologici dovrebbero comunque sempre comprendere la ricerca di batteri, miceti e virus erpetico perché non è infrequente che la cheratite amebica si associ ad infezioni concomitanti che andranno anch’esse adeguatamente trattate.
Nella fase iniziale dell’infezione, quando la membrana di Bowman non è ancora stata superata, il prelievo ha anche un valore terapeutico, in quanto viene rimosso il parassita. Per questo motivo, conviene sempre asportare un’ampia zona di epitelio allo scopo di eliminare tutte le cellule eventualmente infettate.
- Microscopia diretta : le apposizioni o gli “scraping” su vetrino vanno colorati con colorazioni di Gram, Giemsa, PAS, mentre le metodiche tintoriali effettuate su fettine istologiche sparaffinate sono preferenzialmente Giemsa istologico e PAS. Con il microscopio a fluorescenza è possibile evidenziare le cisti ed i trofozoiti dopo colorazione con “calcofluor white”. Si tratta di un fluorocromo che si lega alla cellulosa ed alla chitina presenti nella doppia parete delle cisti, conferendo una chemofluorescenza giallo-verde. I trofozoiti appaiono invece colorati in arancione. Un altro colorante che può essere utilizzato è il lattofenolo cotton blu: in questo caso le cisti appaiono come strutture a doppia parete che si colorano di blu più scuro rispetto al tessuto corneale circostante. Un’ulteriore metodica tintoriale si affida all’utilizzo di lectine fluoresceina-coniugate, come la concanavalina A, che hanno il vantaggio di colorare sia le cisti che i trofozoiti. L’analisi in immunofluorecenza diretta permette di identificare facilmente cisti e trofozoiti, ma è attuabile solo in alcuni laboratori di riferimento.
- Esame colturale: il terreno di coltura sia di isolamento che di mantenimento normalmente utilizzato è un agar non nutriente (NN-agar) al 3%, frazionato in piastre Petri e, dopo solidificazione, batterizzato sterilmente in superficie con sospensione lattescente di una specie batterica Gram – (Escherichia coli, Enterobacter aerogenes ecc.) che funge da supporto nutritivo per le amebe. Dopo alcuni giorni di incubazione a 32°-35°C possono evidenziarsi le forme vegetative in attiva moltiplicazione che causano aree di “spoliazione” del substrato batterico per meccanismi di fagocitosi. E’ opportuno che le piastre vengano tenute in osservazione per almeno 4 settimane poiché talora sono necessari tempi decisamente più lunghi per l’isolamento del ceppo amebico. L’isolamento di Acanthamoeba può anche essere tentato in terreni monofasici liquidi, senza flora batterica come supporto nutritivo (coltura axenica). La coltura axenica (terreno di Fulton, GCVS ecc.) viene di norma effettuata in seconda battuta partendo da una coltura su NN-agar previa eliminazione della flora batterica di accompagnamento. Le colture axeniche permettono di ottenere una popolazione amebica omogenea “pura” che può essere utilizzata per test di farmaco sensibilità in vitro, infezioni sperimentali, test di tipizzazione biochimica e molecolare ecc.
- Microscopia confocale : si tratta di una metodica non invasiva che consente di mettere in evidenza le cisti e i trofozoiti nel tessuto corneale che appaiono come strutture iperiflettenti. L’esame richiede però una buona collaborazione del paziente e, spesso, l’intensa fotofobia ed il dolore ne possono rendere problematica l’esecuzione.
- Tecniche di Polymerase chain reaction (PCR) : molto sensibili e specifiche, consentono di dimostrare la presenza di Acanthamoeba anche in quantità minimali di tessuto corneale. Sono ancora in fase sperimentale ed eseguibili in laboratori di ricerca o di riferimento.